Aktuelle Themen:
MDR
Verordnung (EU) 2017/745 über Medizinprodukte
MPDG
Medizinprodukterecht-Durchführungsgesetz 2022
Straf- und Bußgeldvorschriften
Usability & IEC 62366-1
Die Gebrauchstauglichkeiten von Medizinprodukte
EN ISO 14971
Anwendung des Risikomanagements auf Medizinprodukte
User Centered Design
Mit UCD zu untauglichen Medizinprodukten
Arbeitsgruppen
Webinare
Ziele
- Verbesserte Vigilanzberichterstattung
- Bildung des Kompetenzzentrums
Members area

Definition Gebrauchstauglichkeit (Usability)
Die überwiegende Anzahl der Schäden werden nicht durch ein technisches Versagen des Medizinprodukts, sondern durch mangelnde Gebrauchstauglichkeit verursacht.
Die FDA sagt, dass der Begriff Usability häufig mit Design verwechselt würde, weshalb man besser den Begriff „Human Factors Engineering“ nutzen sollten. In der Tat, Usability hat erst einmal nichts mit schicken Farben und Schlagschatten oder trendigen Design-Elementen zu tun.
Definition der Gebrauchstauglichkeit gemäß ISO 9241
Die ISO 9241 definiert Gebrauchstauglichkeit/Usability als das Ausmaß, in dem ein interaktives System durch bestimmte Benutzer in einem bestimmten Nutzungskontext genutzt werden kann, um bestimmte Ziele effektiv, effizient und zufriedenstellend zu erreichen.
Wichtig bei dieser Definition ist, dass die Gebrauchstauglichkeit eines Medizinprodukts keine absolute Eigenschaft ist, sondern von den Charakteristiken der Nutzer und der Nutzungsumgebung abhängt.
Definition der Gebrauchstauglichkeit gemäß IEC 62366-1
Die Definition des Begriffs Gebrauchstauglichkeit bei der IEC 62366-1 ist sehr ähnlich: Eigenschaft des User Interfaces, die den Gebrauch unterstützt und damit Effektivität, Effizienz sowie Zufriedenheit des Users in der festgelegten Nutzungsumgebung erzielt.
Probleme durch mangelnde Gebrauchstauglichkeit
Ein medizinisches Fachjournal schreibt in einem Artikel: „Nach Prof. Dr. Uvo Hölscher/FH Münster gehen Experten von 17.000 vermeidbaren Anwendungsfehlern mit Todesfolge pro Jahr in deutschen Krankenhäusern aus. Zwei Drittel aller unerwünschten Ereignisse im Rahmen der Medizintechnik beruhen auf Bedien- und nur ein Drittel auf Produktfehlern. […] ”
Abb. 1: An die Krankenhäuser appellierte Hölscher (2. v. r.), die Ergonomie bei Einkaufsentscheidungen stärker zu berücksichtigen als das Design. Einfacheres, sicheres und schnelleres Bedienen würde langfristig zu Einsparungen führen. Quelle: FH Münster
Damit werden die Hersteller nun von zwei Seiten gedrängt, die Gebrauchstauglichkeit ihrer Produkte zu verbessern. Von den Kunden (den Krankenhäusern) ebenso wie von den benannten Stellen, die bei den Audits auf die Einhaltung der Forderungen der IEC 62366-1 achten. Auch die FDA rückt die Gebrauchstauglichkeit (Usability) ins Zentrum ihrer Prüfungen.
Prof. Dr. Christian Johner gründete das Johner-Institut, um Firmen zu beraten, sichere Medizinprodukte zu entwickeln und durch die Regularien zu bringen.

Kein Video zu sehen? Cookies neu setzen
Prof. Dr. Christian Johner zeigt in diesem Video, wie Hersteller Anwendungsfehler bei eigenen Medizinprodukten reduzieren müssen und deren Ursache nicht auf ZahnärztInnen abwälzen dürfen.
EN ISO 14971 Anwendung des Risikomanagements auf Medizinprodukte
Zahnmediziner müssen aufpassen, wenn sich ein Fehler, der zu Patientenverletzungen führt, sich bei vielen Anwendern wiederholt. Dann handelt es sich um einen vernünftigerweise vorhersehbaren Anwendungsfehler (Missbrauch eines Medizinprodukts), der sich nach den neuesten regulatorischen Anforderungen bei Medizinprodukten nicht ein zweites Mal geben darf.
Dass genau dieser Fehler fast täglich und sogar tausendfach wiederholt, zeigt den enormen Nachholbedarf bei Zahnmedizinern.
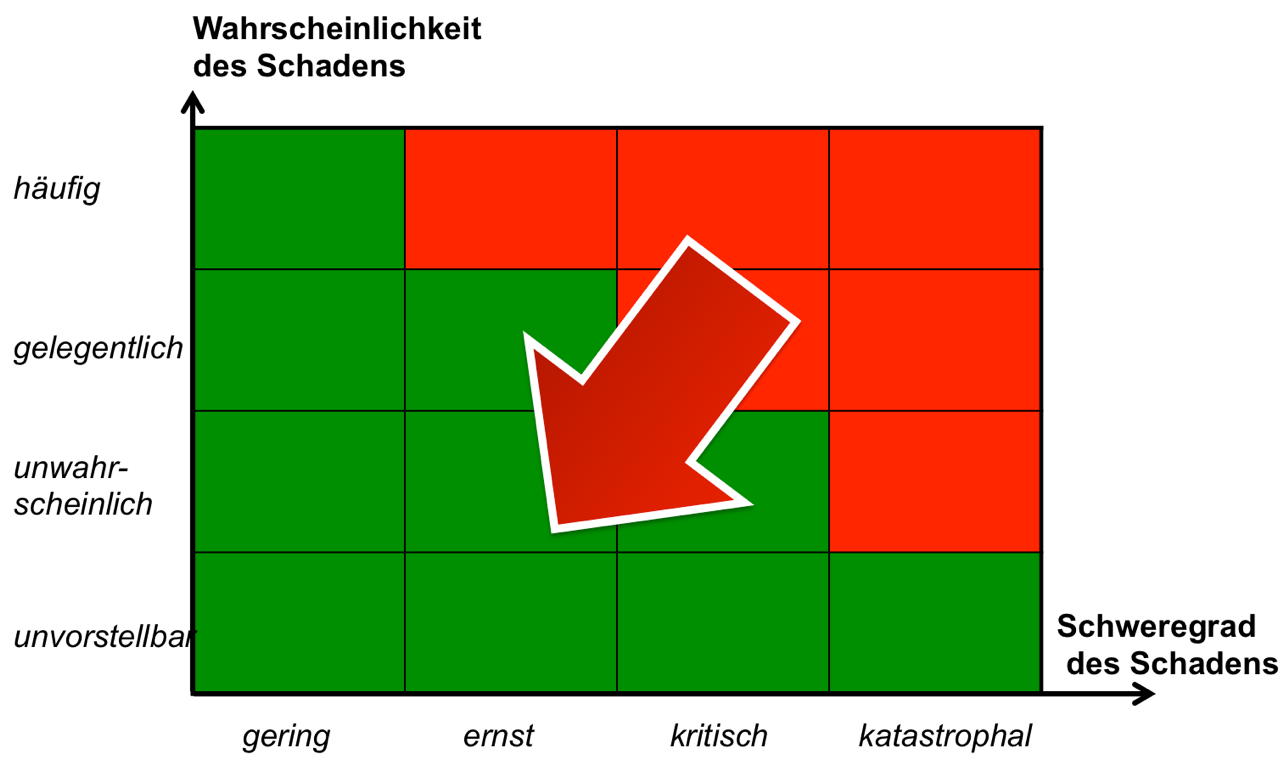
Auch die ISO 14971 fordert keine Risikobewertungsmatrix, auch wenn sie in älteren Ausgaben im informativen Anhang eine abbildete. In diesen älteren Ausgaben unterschied die EN ISO14971 akzeptable Risiken, nicht akzeptable Risiken und Risiken im Bereich ALARP(„as low as reasonable practical“). Seit der 2012-er Ausgabe der EN ISO 14971 gibt es keine pauschal akzeptablen Risiken mehr. Die Unterteilung in akzeptable, nicht akzeptable und ALARP-Risiken ist somit obsolet. Vielmehr müssen Risiken „as low as reasonable possible“ sein.
Bereits beimersten Schritt im Risikomanagement, nämlich die Festlegung der Risikopolitik(in der Risikobewertungsmatrix ausgedrückt alsAbgrenzung zwischen roten und gelben Bereichen), unterlaufen Medizinprodukteherstellern zahlreiche Fehler, die alle weiteren Aktivitätenad absurdum führen.
Fehlentwicklung: Medizinprodukte im User Centered Design sind besonders betroffen!
Das User Centered Design zielt darauf ab, künftige Anwender von Anfang an in die Entwicklung einzubeziehen. So einleuchtend dieser Ansatz klingt, so häufig führt er zu fatalen Fehlentwicklungen. Sie erreichen das Gegenteil dessen, was Sie wollten, nämlich unsichere und gebrauchsuntaugliche Produkte, die gegen regulatorische Vorgaben verstoßen.
In der Medizin und auch Zahnmedizin sind die Medizinprodukte, die von den Anwendern favorisiert sind, besonders solche, die keine für die Patienten optimierten Medizinprodukte sind und sogar diese unnötig in der Gesundheit und Integrität gefährden.
Darüberhinaus gefährdet das oft mit einem Hype versehende ‚User Centered Design‘ auch massiv weitere Innovationen bei Medizinprodukten, um potentielle Patientengefährdungen zu reduzieren.
Einen Hype zu brechen, gestaltet sich so zu einer unlösbaren Aufgabe.
Deshalb darf bei der Entwicklung von Medizinprodukten auf ausgebildete Usability-Engineers nicht verzichtet werden.
Der Glaube, dass man nur die Nutzer bei der Entwicklung eng genug einbinden müsse, um zu gebrauchstauglichen Produkten zu kommen, ist ein Irrglaube. Im schlimmsten Fall, beziehen Hersteller nur viele Menschen mit ein, die
Mittlerweile sind so viele Firmen auf einen am Markt sehr erfolgreichen Zug (Digital ist die Zukunft! Dabei ist das Merging gemeint.) aufgesprungen und glauben nicht, dass es ein Problem überhaupt gibt.
Prof. Dr. Gunter Dueck beschreibt es als Schwarmdummheit.
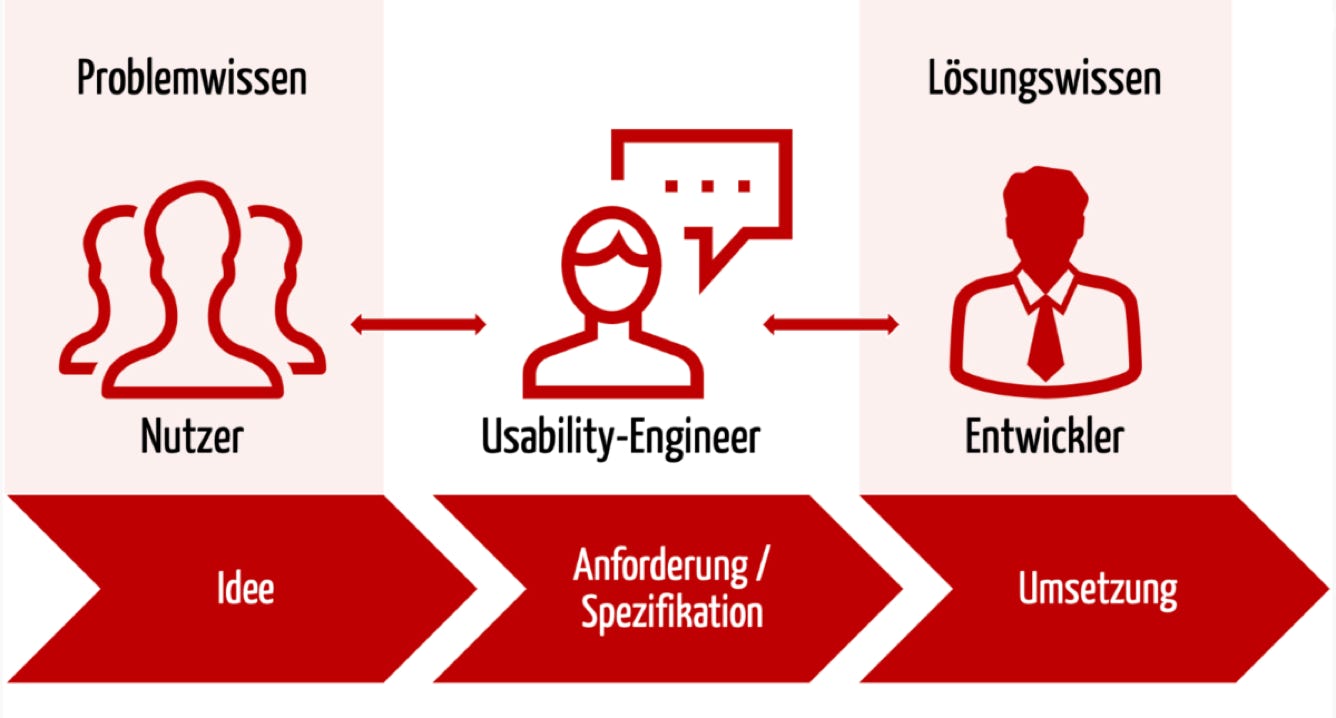
Nutzer sind Experten für den Nutzungskontext. Aber in ihrer Rolle als Nutzer sind sie weder Requirements-Engineers noch Interaktionsdesigner noch Usability-Experten. Sie verfügen nicht über deren Kompetenzen und beherrschen nicht den Prozess einer normenkonformen, „gebrauchstauglichkeitsorientierten Entwicklung“, wie das die IEC 62366-1 nennt.
Genau diese Fähigkeiten und Kompetenzen müssen die Hersteller aber bestimmen und nachweisen, und zwar bei der Entwicklung jedes Produkts erneut!
Wenn die Hersteller die Nutzer bei der Entwicklung ihrer Produkte mit einbeziehen, sollten sie sie im Rahmen von Kontextinterviews befragen. Sie dürfen sie aber keine Spezifikationen mitbestimmen lassen und sollten deren Rolle in diesem Bereich beschränken.
Weitere Informationen zum User Centered Design, den Fehlentwicklungen bei Medizinprodukten und den vielen manipulativen in Fachzeitschriften veröffentlichten Fake-Studien erfahren Sie in den Webinaren. Welche Webinare wann stattfinden erfahren Sie hier.

Interimsvorstand der DGMPS Dr. Axel Scheffer, Am Wasserturm 1, D-40668 Meerbusch,
Tel.: 0162 9695123, vorstand@dgmps.de Impressum
Diese Website verwendet Cookies. Bitte lesen Sie unsere Datenschutzerklärung für Details.
Verweigern
OK