Aktuelle Themen:
MDR
Verordnung (EU) 2017/745 über Medizinprodukte
MPDG
Medizinprodukterecht-Durchführungsgesetz 2022
Straf- und Bußgeldvorschriften
Usability & IEC 62366-1
Die Gebrauchstauglichkeiten von Medizinprodukte
EN ISO 14971
Anwendung des Risikomanagements auf Medizinprodukte
User Centered Design
Mit UCD zu untauglichen Medizinprodukten
Arbeitsgruppen
Webinare
Ziele
- Verbesserte Vigilanzberichterstattung
- Bildung des Kompetenzzentrums
Members area
Arbeitsgruppe: Klinische Bewertung von kritischen Medizinprodukten
Zu jedem Medizinprodukt muss eine klinische Bewertung vorliegen. Diese klinische Bewertung kann durch klinische Studienergebnisse definiert werden. In der Zahnmedizin wurden in der Vergangenheit immer wieder nur Prüfstandergebnisse (In-Vitro-Studien), die nur Bereiche des Herstellungsprozesses ohne Fehlerquelle während des Gebrauchs oder Missbrauchs (Usability) widerspiegeln, zitiert. Dies verzerrt die Bewertung, so dass sie in der Vergangenheit stets manipulativ eingesetzt wurde, um minderwertige Medizinprodukte als herausragend gut zu bezeichnen.
Jetzt hat Brüssel zu Recht einen Riegel vorgeschoben, um die Patientensicherheit voranzubringen.
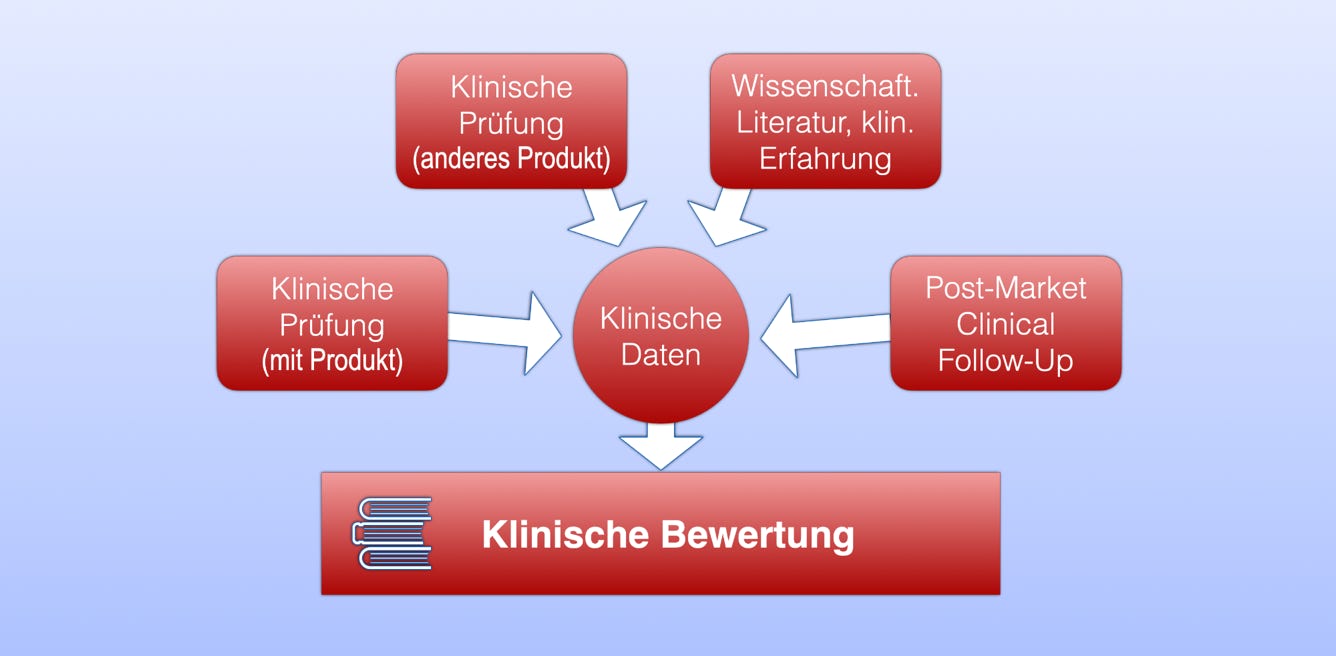
Definition: „klinische Bewertung“ bezeichnet einen systematischen und geplanten Prozess zur kontinuierlichen Generierung, Sammlung, Analyse und Bewertung der klinischen Daten zu einem Produkt, mit dem Sicherheit und Leistung, einschließlich des klinischen Nutzens, des Produkts bei vom Hersteller vorgesehener Verwendung überprüft wird. (MDR Artikel 2, Satz 44)
Die klinische Bewertung ist nicht nur Pflicht, sondern vor allem ein Prozess. Wenn dieser
rechtzeitig gestartet und regelmäßig fortgeführt wird, kann er jedem Hersteller einen großen Nutzen bringen.
In-Vitro-Studien untersuchen nur Bereiche des Herstellungsprozesses ohne Fehlerquellen während des Gebrauchs und Missbrauchs (Usability). Reine Prüfstandversuche ohne Aussagekraft! Ähnlich wie beim Dieselskandal wurden hier In-Vitro-Studien manipulativ eingesetzt! So hat man minderwertige Medizinprodukte zu den besten und präzisesten gekürt.
Die In-Vitro-Studien müssen bei der klinischen Bewertung seit Einführung der MDR von MPs völlig unberücksichtigt bleiben!

Kein Video zu sehen? Cookies neu setzen
Prof. Dr. Christian Johner erklärt genau, wie man gezielt zur klinischen Bewertung von Medizinprodukten kommt. Vorlieben und gehypte Produkte dürfen nicht hineingezogen werden.
Wenn durch Medizinprodukte aufgrund von Fehlbedienung zu Verletzungen von Patienten gekommen ist, muss der Hersteller sofort handeln.
Die Hersteller von Software dürfen nicht erst seit Einführung der MDR keine Fehlbedienungen der Software, die zu klinisch nicht akzeptablen Gefährdungen führen können, dulden. Sie müssen adäquat auf diese Gefährdungen reagieren, statt die Schuld einfach von sich zu weisen und auf die Mediziner abzuwälzen.
Auch vielen Zahnmedizinerinnen und Zahnmedizinern ist nicht klar, dass sie oft nicht selbst schuld an einem Misserfolg sind, sondern dass es an einer mangelnden Gebrauchstauglichkeit der verwendeten softwarebasierten Medizinprodukte liegen kann, die der Hersteller zu verantworten hat. Eine mangelnde Gebrauchstauglichkeit eines Medizinprodukts ist immer ein generelles Problem, das dazu führen kann, dass Mediziner eine unerwünschte schwerwiegende Verschlechterung des Gesundheitszustandes eines Patienten herbeiführen können. Der Begriff „schwerwiegend“ ist insbesondere dann anzunehmen, wenn es in Zusammenhang mit einem dentalen Medizinprodukt zu einer anhaltenden Schädigung von Körper-Strukturen oder - Funktionen kommt beziehungsweise eine zusätzliche zahnärztliche/ärztliche Intervention notwendig wird, um solch eine Schädigung zu verhindern oder zu behandeln.
Die immer wiederkehrenden risikoreichen Anwendungen sind bereits den Herstellern bekannt. Sie dürfen die vorhersehbaren Verletzungen nicht dulden oder mit haltlosen Versprechungen sogar herbeiführen.

Prof. Dr. Flügge erkannte in ihrer Studie klinisch inakzeptable Ergebnisse eines bestimmten Typs von Medizinprodukten. Welche Fachgesellschaft hier dies trotzdem relativiert haben und für akzeptabel befunden haben, erfahren Sie in den Webinaren.
Welche Webinare wann stattfinden erfahren Sie hier.
Die klinische Bewertung ist das Rückgrat eines Medizinprodukts
Die klinische Bewertung ist der Teil der technischen Dokumentation, in dem alles Wissen zusammenfließt. Sie soll die Sicherheit der Patienten erhöhen. Daher stellen die Gesetzgeber in Regularien wie der MDR hohe Anforderungen.
Interimsvorstand der DGMPS Dr. Axel Scheffer, Am Wasserturm 1, D-40668 Meerbusch,
Tel.: 0162 9695123, vorstand@dgmps.de Impressum
Diese Website verwendet Cookies. Bitte lesen Sie unsere Datenschutzerklärung für Details.
Verweigern
OK